Путешествие электронов туда и обратно или химия, химия, вся эмблема синяя
Функционал аккумуляторной батареи давно стал для нас привычным, обыденным. Все знают, что аккумулятор – это прибор, который можно «зарядить» и получать электрическую энергию от него до тех пор, пока тот не «сядет». Потом процесс можно повторить, но, как правило, в какой-то момент аккумулятор перестанет «держать заряд».
Между тем, немногие знают, что именно позволяет работать аккумулятору в таком циклическом режиме.
Основной принцип работы аккумуляторной батареи – обратимость химической реакции, которая приводит к возникновению электрического тока.
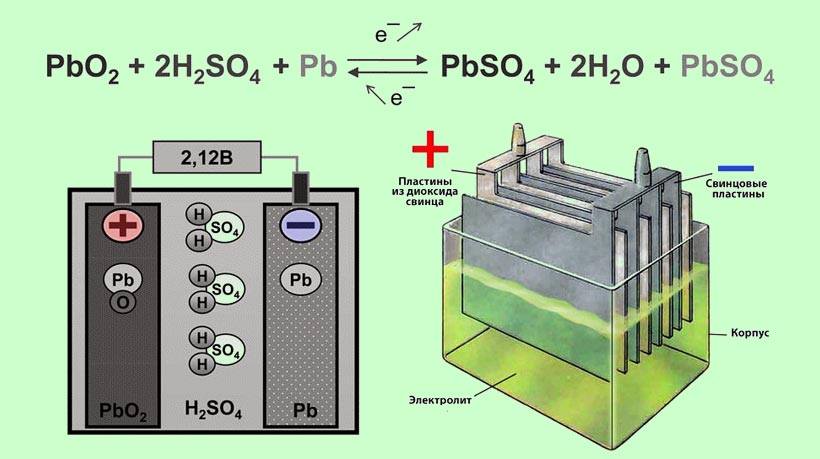
Пластины аккумулятора изготавливаются из диоксида свинца и металлического губчатого свинца с разными добавками, которые увеличивают прочность пластин. Электролитом служит водный раствор серной кислоты. Между двумя электродами в электролитной среде протекает окислительно-восстановительная реакция, обратимость которой и позволяет многократно производить заряд и разряд аккумулятора.
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов – это окисление. При окислении степень окисления вещества-донора электронов повышается. Процесс присоединения электронов — это восстановление. При восстановлении степень окисления вещества-акцептора электронов понижается.
При работе аккумулятора, то есть его разряде, металлический свинец, являющийся в данном случае восстановителем, отдает электроны, окисляясь при этом. Иными словами, вступая в реакцию с кислотным остатком серной кислоты, свинец увеличивает степень своего окисления (отрицательно заряженный анод).
Диоксид свинца в данном случае является окислителем, то есть восстанавливается, принимая электроны, уменьшая степень своего окисления (положительно заряженный катод).
Электроны в результате описанной реакции передаются по внешней цепи от отрицательно заряженного анода на положительно заряженный катод. Иными словами, возникает электрический ток в цепи.
Для заряда аккумулятор подключают к внешнему источнику тока (плюсом к плюсу и минусом к минусу). При этом ток протекает через аккумулятор в направлении, обратном тому, в котором он проходил при разряде аккумулятора.
В результате этого электрохимические процессы на электродах протекают в обратном направлении. На свинцовом электроде теперь происходит процесс восстановления (уменьшается степень окисления) и этот электрод становится катодом. На электроде из диоксида свинца при заряде идет процесс окисления, следовательно, этот электрод теперь является анодом.
Таким образом, электроны «путешествуют» между пластинами, меняя степень окисления то одного, то другого электрода. Также следует отметить, что при разряде в электролите аккумулятора увеличивается удельный вес воды, а при заряде увеличивается удельный вес серной кислоты.
В силу различных причин, в основном связанных с разрушением материалов, используемых в реакции, описанная выше обратимость электрохимических процессов не является вечной, то есть каждый аккумулятор имеет свой срок нормальной эксплуатации. Вечных аккумуляторов не бывает, вопрос лишь в том, сколько лет проработает ваш, и что нужно сделать, чтобы немного продлить срок его службы. Об этом читайте в следующих публикациях.